Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

a, PT: \(Fe+2HCl\rightarrow FeCl_2+H_2\)
Ta có: \(n_{Fe}=n_{H_2}=\dfrac{6,72}{22,4}=0,3\left(mol\right)\)
Coi hh X gồm: Fe, Cu và O.
Ta có: nFe = 0,3 (mol)
Quá trình khử oxit: \(H_2+O_{\left(trongoxit\right)}\rightarrow H_2O\)
\(\Rightarrow n_{O\left(trongoxit\right)}=n_{H_2}=\dfrac{13,44}{22,4}=0,6\left(mol\right)\)
⇒ mCu = 39,2 - mFe - mO (trong oxit) = 39,2 - 0,3.56 - 0,6.16 = 12,8 (g)
BTNT Cu, có: \(n_{CuO}=n_{Cu}=\dfrac{12,8}{64}=0,2\left(mol\right)\)
\(\Rightarrow\left\{{}\begin{matrix}\%m_{CuO}=\dfrac{0,2.80}{39,2}.100\%\approx40,82\%\\\%m_{Fe_xO_y}\approx100-40,82\approx59,18\%\end{matrix}\right.\)
b, Ta có: \(m_{Fe_xO_y}=39,2-m_{CuO}=23,2\left(g\right)\)
⇒ mO (trong FexOy) = 23,2 - mFe = 6,4 (g) \(\Rightarrow n_O=\dfrac{6,4}{16}=0,4\left(mol\right)\)
⇒ x:y = 0,3:0,4 = 3:4
Vậy: CTHH cần tìm là Fe3O4.

1 ) CAO +H2O => CA(OH)2 (1)
2K + 2H2O => 2KOH + H2(2)
n (H2) =1,12/22,4 =0,05
theo ptpư 2 : n(K) = 2n (h2) =2.0.05=0,1(mol)
=> m (K) =39.0,1=3,9 (g)
% K= 3,9/9,5 .100% =41,05%
%ca =100%-41,05%=58,95%
xo + 2hcl =>xcl2 +h2o
10,4/X+16 15,9/x+71
=> giải ra tìm đc X bằng bao nhiêu thì ra

Gọi \(\left\{{}\begin{matrix}n_{CuO}=a\left(mol\right)\\n_{Fe_xO_y}=a\left(mol\right)\end{matrix}\right.\)
=> 80a + 56ax + 16ay = 2,4 (1)
\(n_{H_2}=\dfrac{0,448}{22,4}=0,02\left(mol\right)\)
PTHH: CuO + H2 --to--> Cu + H2O
FexOy + yH2 --to--> xFe + yH2O
a---------------->ax
Fe + 2HCl --> FeCl2 + H2
ax--------------------->ax
=> \(ax=0,02\left(mol\right)\)
=> a = \(\dfrac{0,02}{x}\)
Thay vào (1)
\(80.\dfrac{0,02}{x}+56.0,02+\dfrac{16.0,02y}{x}=2,4\)
=> \(\dfrac{1,6}{x}+\dfrac{0,32y}{x}=1,28\)
=> 1,28x = 0,32y + 1,6
Chọn x = 2; y = 3 thỏa mãn
=> CTHH: Fe2O3

\(n_{H_2}=\dfrac{4,48}{22,4}=0,2\left(mol\right)\\ n_{Cl_2}=\dfrac{5,6}{22,4}=0,25\left(mol\right)\)
Giả sử M trước H có:
\(Mg+H_2SO_4\rightarrow MgSO_4+H_2\)
x------------------------------->x
\(M+H_2SO_4\rightarrow MSO_4+H_2\)
y------------------------------>y
Có:
\(m_X=24x+Mx=8\\ \Sigma n_{H_2}=x+y=0,2\left(mol\right)\left(1\right)\)
Mặt khác:
\(Mg+Cl_2\rightarrow MgCl_2\)
x---->x
\(2M+3Cl_2\rightarrow2MCl_3\)
y---->1,5y
Có: \(\Sigma n_{Cl_2}=x+1,5y=0,25\left(mol\right)\left(2\right)\)
Từ (1), (2) có hệ phương trình: \(\left\{{}\begin{matrix}x+y=0,2\\x+1,5y=0,25\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}x=0,1\\y=0,1\end{matrix}\right.\)
\(\Rightarrow24.0,1+0,1M=8\\ \Rightarrow M=56g/mol\)
Giả sử đúng, kim loại M là Fe.

Gọi CT oxit sắt là FexOy
Gọi nCu=a(mol)
nH2=\(\dfrac{6,72}{22,4}\)=0,3(mol)
FexOy+yH2to→xFe+yH2O(1)
Fe+2HCl→FeCl2+H2(2)
Theo pthh(2)
nFe=nH2=0,3(mol)
Theo pthh(1)
nFexOy=\(\dfrac{0,3}{x}\)(mol)
Ta có: 64a+56.0,3=29,6
⇒a=0,2(mol)
⇒mCu=0,2.64=12,8(g)
⇒mFexOy=36−12,8=23,2(g)
=>MFexOy= \(\dfrac{\dfrac{23,2}{0,3}}{x}\)=\(\dfrac{232x}{3}\)
=>56x+16y=\(\dfrac{232x}{3}\)
=>\(\dfrac{64x}{3}=16y\)
->\(\dfrac{x}{y}=\dfrac{3}{4}\)
⇒CTHH:Fe3O4
Ta có :
%m Cu=\(\dfrac{12,8}{36}100\)=35,56%
=>%m Fe3O4=100%-35,56%=64,44%
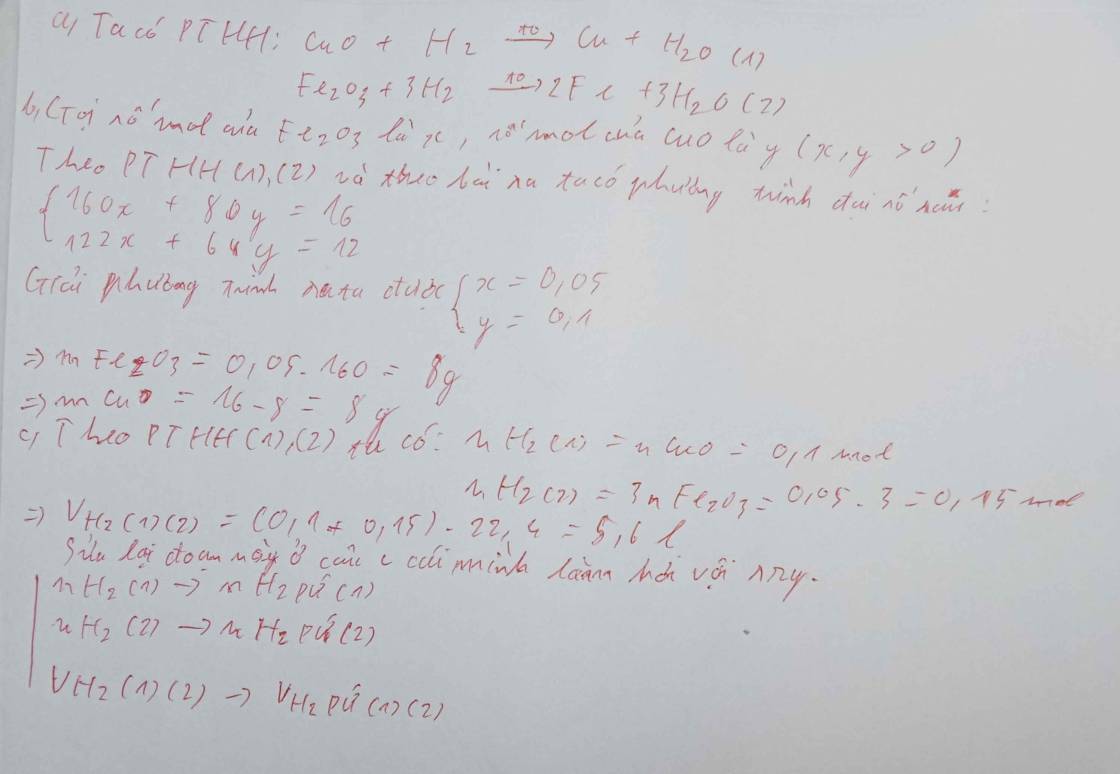
3,6 gam chất rắn không tan là Cu
\(n_{CuO} = n_{Cu} = \dfrac{3,6}{64}= 0,05625(mol)\\ Fe + 2HCl \to FeCl_2 + H_2\\ n_{Fe} = n_{H_2} =\dfrac{3,36}{22,4}= 0,15(mol)\\ m_X = m_{CuO} + m_{oxit\ sắt} \Rightarrow m_{oxit\ sắt} =15,6 -0,05625.80 = 11,1(gam)\\ m_{Oxit\ sắt} = m_{Fe} + m_{O(trong\ oxit\ sắt)}\\ Rightarrow n_O = \dfrac{11,1-0,15.56}{16} = 0,16875(mol)\\ \dfrac{n_{Fe}}{n_O} = \dfrac{0,15}{0,16875} = \dfrac{8}{9}\)
(Sai đề)