Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

| So sánh | Liên kết ion | Liên kết cộng hóa trị không có cực | Liên kết cộng hóa trị có cực |
| Giống nhau | Các nguyên tử kết hợp với nhau để tạo ra cho mỗi nguyên tử lớp electron ngoài cùng bền vững giống cấu trúc khí hiếm (2e hoặc 8e) | ||
| Khác nhau về cách hình thành liên kết | Cho và nhận electron | Dùng chung e, cặp e không bị lệch | Dùng chung e, cặp e bị lệch về phía nguyên tử có độ âm điện mạnh hơn |
| Khác nhau về nguyên tố tạo nên liên kết | Giữa kim loại và phi kim | Giữa các nguyên tử của cùng một nguyên tố phi kim | Giữa phi kim mạnh và yếu khác |
| Nhận xét | Liên kết cộng hóa trị có cực là dạng trung gian giữa liên kết cộng hóa trị không cực và liên kết ion |
1. Giống nhau
Tất cả các loại liên kết này đều có mục đích chung là giúp các nguyên tử đạt được cấu hình electron ổn định (thường là cấu hình giống khí hiếm), bằng cách chia sẻ hoặc chuyển giao electron.
2. Khác nhau
a. Liên kết ion
- Định nghĩa: Là liên kết hình thành khi một nguyên tử (hoặc ion) mất electron và một nguyên tử khác nhận electron, tạo thành hai ion mang điện tích trái dấu (ion dương và ion âm) và hút nhau nhờ lực hút tĩnh điện.
- Đặc điểm:
- Xảy ra giữa các nguyên tử có sự chênh lệch độ âm điện lớn (thường giữa kim loại và phi kim).
- Thường xảy ra giữa nguyên tử kim loại (có xu hướng cho đi electron) và phi kim (có xu hướng nhận electron).
- Ví dụ: NaCl (natri clorua), MgO (magie oxit).
- Các hợp chất ion có thể dễ dàng hòa tan trong nước và dẫn điện trong trạng thái lỏng hoặc dung dịch.
b. Liên kết cộng hóa trị không có cực
- Định nghĩa: Là liên kết hình thành khi hai nguyên tử chia sẻ một cặp electron với nhau, và độ âm điện của hai nguyên tử gần như bằng nhau.
- Đặc điểm:
- Xảy ra giữa các nguyên tử có độ âm điện tương đối giống nhau (chênh lệch độ âm điện nhỏ).
- Thường xảy ra giữa các nguyên tử phi kim.
- Ví dụ: H₂, O₂, N₂.
- Các phân tử cộng hóa trị không có cực có xu hướng không tan trong nước và không dẫn điện.
c. Liên kết cộng hóa trị có cực
- Định nghĩa: Là liên kết hình thành khi hai nguyên tử chia sẻ một cặp electron, nhưng vì sự khác biệt về độ âm điện giữa chúng, các electron được chia sẻ không đều, tạo ra một phân tử có cực.
- Đặc điểm:
- Xảy ra giữa các nguyên tử có độ âm điện khác nhau, nhưng chênh lệch không quá lớn để tạo ra liên kết ion.
- Tạo ra một phân tử có cực, với một phần của phân tử mang điện tích dương (dưới mức nhỏ) và phần còn lại mang điện tích âm.
- Ví dụ: H₂O (nước), HF (axit hydrofluoric).
- Các phân tử này có thể hòa tan trong nước và có tính dẫn điện yếu.
Tóm lại:
Đặc điểm | Liên kết ion | Liên kết cộng hóa trị không có cực | Liên kết cộng hóa trị có cực |
|---|---|---|---|
Cách hình thành | Chuyển electron từ nguyên tử này sang nguyên tử khác | Chia sẻ electron giữa hai nguyên tử | Chia sẻ electron nhưng không đều, tạo ra cực |
Độ âm điện | Chênh lệch lớn (thường là giữa kim loại và phi kim) | Chênh lệch nhỏ (giữa các nguyên tử phi kim) | Chênh lệch vừa phải (giữa phi kim và phi kim) |
Tính chất phân tử | Có cực, tạo thành tinh thể ion | Không có cực, phân tử trung hòa | Có cực, phân tử có tính phân cực |
Ví dụ | NaCl, MgO | H₂, O₂, N₂ | H₂O, HF |
Dẫn điện | Dẫn điện trong dung dịch hoặc trạng thái lỏng | Không dẫn điện | Có thể dẫn điện yếu trong dung dịch |
Tính tan trong nước | Tan trong nước | Thường không tan trong nước | Tan trong nước |
Kết luận:
- Liên kết ion xảy ra giữa các ion với độ âm điện chênh lệch lớn, tạo ra tính dẫn điện và tan trong nước.
- Liên kết cộng hóa trị không có cực chia sẻ electron đều và tạo thành các phân tử trung hòa không có cực, không dẫn điện.
- Liên kết cộng hóa trị có cực chia sẻ electron không đều, tạo ra các phân tử có cực, có khả năng hòa tan trong nước và dẫn điện yếu.

Tham khảo:
| So sánh | Liên kết ion | Liên kết cộng hóa trị không có cực | Liên kết cộng hóa trị có cực |
| Giống nhau | Các nguyên tử kết hợp với nhau để tạo ra cho mỗi nguyên tử lớp electron ngoài cùng bền vững giống cấu trúc khí hiếm (2e hoặc 8e) | ||
| Khác nhau về cách hình thành liên kết | Cho và nhận electron | Dùng chung e, cặp e không bị lệch | Dùng chung e, cặp e bị lệch về phía nguyên tử có độ âm điện mạnh hơn |
| Khác nhau về nguyên tố tạo nên liên kết | Giữa kim loại và phi kim | Giữa các nguyên tử của cùng một nguyên tố phi kim | Giữa phi kim mạnh và yếu khác |

So sánh | Liên kết ion | Liên kết cộng hóa trị không có cực | Liên kết cộng hóa trị có cực |
Giống nhau | Các nguyên tử kết hợp với nhau để tạo ra cho mỗi nguyên tử lớp electron ngoài cùng bền vững giống cấu trúc khí hiếm ( 2e hoặc 8e ). | ||
Khác nhau về cách hình thành liên kết | Cho và nhận electron | Dùng chung e, cặp e không bị lệch | Dùng chung e, cặp e bị lệch về phía nguyên tử có độ âm điện mạnh hơn. |
Khác nhau về nguyên tố tạo nên liên kết | Giữa kim loại và phi kim | Giữa các nguyên tử của cùng một nguyên tố phi kim | Giữa phi kim mạnh yếu khác nhau |
Nhận xét | Liên kết cộng hóa trị có cực là dạng trung gian giữa liên kết cộng hóa trị không cực và liên kết ion. |

Liên kết trong các oxit đó là liên kết giữa oxi và các nguyên tố thuộc chu kì 3.
Căn cứ vào hiệu độ âm điện, có thể dự đoán liên kết trong các oxit : Na 2 O , MgO, Al 2 O 3 là liên kết ion, liên kết trong các oxit : SiO 2 , P 2 O 5 , SO 2 là các liên kết cộng hoá trị có cực, liên kết trong oxit Cl 2 O 7 là liên kết cộng hoá trị không cực

Liên kết ion là liên kết được hình thành bởi lực hút tĩnh điện giữa các ion mang điện trái dấu.
Thí dụ : K+ + Cl- → KCl.
Liên kết cộng hóa trị không cực là liên kết được tạo nên giữa hai nguyên tử bằng những cặp electron chung.
Thí dụ:
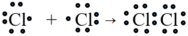
Liên kết cộng hóa trị trong đó cặp electron chung bị lệch về phía một nguyên tử được gọi là liên kết cộng hóa trị có cực
Thí dụ:
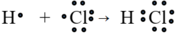
hay H – Cl

Liên kết cộng hoá trị phân cực (có cực) là liên kết giữa hai nguyên tử khác nhau có hiệu độ âm điện từ 0,4 đến < 1,7 ; các cặp electron phân bỏ lệch về phía nguyên tử có độ âm điện lớn.
Thí dụ
HCl : H:Cl
HF: H:F

-
-
- Liên kết cộng hóa trị không cực: Hai nguyên tử chia sẻ electron một cách đều đặn.
- Liên kết cộng hóa trị có cực: Hai nguyên tử chia sẻ electron không đều đặn, một nguyên tử thu hút electron mạnh hơn nguyên tử còn lại.
2. Sự hình thành liên kết:Liên kết ion: Các nguyên tử liên kết ion với nhau để đạt được cấu hình electron bền vững (như cấu hình khí hiếm) bằng cách chuyển nhượng electron từ nguyên tử này sang nguyên tử khác. Khi một nguyên tử mất electron, nó mang điện tích dương (ion dương - cation), và khi nguyên tử nhận electron, nó mang điện tích âm (ion âm - anion). Sự tương tác giữa các ion mang điện tích trái dấu này tạo nên liên kết ion.
Liên kết cộng hóa trị (LKCH): Các nguyên tử liên kết cộng hóa trị với nhau bằng cách chia sẻ electron để đạt được cấu hình electron bền vững. Mục tiêu của liên kết cộng hóa trị là giúp các nguyên tử tham gia chia sẻ electron, để mỗi nguyên tử có thể "giống như" khí hiếm trong cấu hình electron của mình. Trong liên kết cộng hóa trị có thể có:
-
-
3. Điều kiện của liên kết ion và liên kết cộng hóa trị:Liên kết ion: Liên kết ion hình thành khi một nguyên tử (thường là kim loại) mất electron để trở thành ion dương (cation), trong khi một nguyên tử khác (thường là phi kim) nhận electron để trở thành ion âm (anion). Ví dụ, trong phản ứng giữa natri (Na) và clo (Cl), natri mất một electron và trở thành Na⁺, còn clo nhận một electron để trở thành Cl⁻. Sự tương tác giữa các ion mang điện tích trái dấu tạo nên liên kết ion, hình thành hợp chất ion (ví dụ: NaCl - muối ăn).
Liên kết cộng hóa trị: Liên kết cộng hóa trị hình thành khi hai nguyên tử chia sẻ electron với nhau để đạt được cấu hình electron ổn định. Nếu cả hai nguyên tử đều có độ âm điện tương đương, chúng sẽ chia sẻ electron một cách đều đặn, tạo ra liên kết cộng hóa trị không cực (ví dụ: phân tử H₂, O₂). Nếu một nguyên tử có độ âm điện mạnh hơn, nó sẽ thu hút electron từ nguyên tử còn lại mạnh hơn, tạo ra liên kết cộng hóa trị có cực (ví dụ: phân tử H₂O, trong đó O thu hút electron mạnh hơn H).
-
- Liên kết ion thường xảy ra giữa kim loại và phi kim.
- Độ chênh lệch điện tích (độ âm điện) giữa hai nguyên tử phải đủ lớn (thường là trên 1,7 trên thang độ âm điện Pauling) để một nguyên tử có thể mất electron và nguyên tử kia có thể nhận electron.
- Các nguyên tử phải có sự khác biệt lớn về khả năng nhận và cho electron, như trong các trường hợp kim loại (cho electron) và phi kim (nhận electron).
-
- Liên kết cộng hóa trị thường xảy ra giữa phi kim và phi kim.
- Nếu độ âm điện giữa hai nguyên tử nhỏ, liên kết cộng hóa trị sẽ không cực, tức là các electron được chia sẻ đều (ví dụ, H₂, O₂).
- Nếu độ âm điện giữa hai nguyên tử có sự khác biệt đáng kể, liên kết cộng hóa trị sẽ có cực, tức là một nguyên tử sẽ thu hút electron mạnh hơn, tạo ra sự phân cực điện tích (ví dụ: H₂O, trong đó O mang phần điện tích âm và H mang phần điện tích dương).
4. Liên kết cộng hóa trị (LKCH) không cực và có cực:Liên kết ion:
Liên kết cộng hóa trị:
Liên kết cộng hóa trị không cực:
Liên kết cộng hóa trị có cực: