

Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.



Giải thích:
Do cả Cr và Cr2O3 đều không tác dụng với kiềm loãng nên chỉ có Al và Al2O3 phản ứng với NaOH loãng
nNaOH = nAl = 0,3 mol
=> mCr2O3 = 23,3 – 0,3.27 = 15,2 (g) => nCr2O3 = 0,1 mol
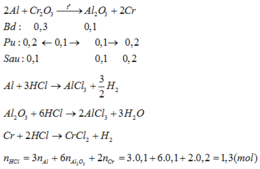
Đáp án B

Xét trường hợp Al dư: 2Al + Cr2O3 → 2Cr + Al2O3 (chọn ẩn cho mỗi phần)
2x x
Gọi y là số mol Al dư → 52.2x + 102x + 27y = 46,6:2 ; y + 2x = 0,3 → x = y = 0,1 mol.
Bảo toàn điện tích: nHCl = 6nAl2O3 + 3nAl3+ + 2nCr2+ = 1,3 mol.

Giải thích:
Phản ứng xảy ra hoàn toàn, chất rắn sau phản ứng + NaOH thu được khí H2 => chứng tỏ có Al dư sau phản ứng => phản ứng nhiệt nhôm oxit sắt hết. Chất rắn Y gồm có Al2O3, Fe và Al dư
Phần 2: nFe = 16,8 : 56 = 0,3 (mol) ;
Bảo toàn e => 3nAl dư = 2 nH2 => nAl = 2/3. nH2 = a (mol)
Phần 1: Nếu không tạo muối NH4NO3 thì ne ( Fe, Al dư) nhường = ne (NO nhận)
=> 0,3. 3 + 3a = 3a => vô lí
Vậy phải tạo muối NH4NO3
=> nNH4NO3 = ( 3nFe + 3nAl – 3nNO)/8 = ( 0,3. 3+ 3a – 3a) /8 = 0,1125 (mol)
mmuối = mFe(NO3)3 + mAl(no3)3 + mNH4NO3
=> mAl(NO3)3 = 233,7 – 0,3. 242 – 0,1125.80 = 152, 1(g)
nAl(NO3)3 ≈ 0,714 (mol)
Rắn Y phản ứng vừa đủ với dd NaOH
Al2O3 + 2NaOH → 2NaAlO2 + H2O
Al + NaOH → NaAlO2 + 3/2H2
=> nNaOH = nNaAlO2- = nAl(NO3)3 = 0,714 (mol) ( Bảo toàn nguyên tố Al)
=> VNaOH = 0,714: 2 = 0,357 (lít) = 357 (ml)
Gần nhất với 352 ml
Đáp án D

Đáp án C
Cr2O3 + 2Al → t 0 Al2O3 + 2Cr
Phần 2: + NaOH đặc nóng → 0,075 mol H2
![]()
Phần 1: + HCl loãng, nóng → 0,15 mol H2
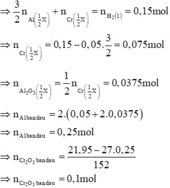
Có 0 , 1 1 < 0 , 25 2 => tính hiệu suất theo lượng Cr2O3 phản ứng.
![]()